Характеризация подкожной in vivo модели почечно-клеточного рака Renca у мышей линии BALB/c
Characterization of a subcutaneous in vivo model of renal cell carcinoma Renca in BALB/c mice
Артём Алексеевич Мишуков1,*
1Центр теоретических проблем физико-химической фармакологии РАН, ул. Средняя Калитниковская, д. 30, Москва, Россия, 109029
* Correspondence: artem.mishukov1999@gmail.com,
Artem A. Mishukov Мишуков1,*
1 Center for Theoretical Problems of Physicochemical Pharmacology RAS, 30 Srednyaya Kalitnikovskaya St., Moscow, Russia, 109029
Получено: 30.03.2024 Принято к публикации: 14.04.2024 Опубликовано: 30.06.2024
EDN: NQYVUM
Аннотация
Почечно-клеточный рак (ПКР) — агрессивное онкологическое заболевание, часто диагностируемое на стадии метастазирования, что значительно снижает выживаемость пациентов. Активное участие в процессах метастазирования рака почки играет система гемостаза, что делает актуальным разработку in vivo животных моделей для исследования механизмов взаимодействия опухолей с системой свертывания и тромбоцитами. Среди них сингенная модель Renca у мышей линии BALB/c отличается низкой стоимостью, сохранением нативного иммунитета и высокой скоростью развития туморогенеза. В настоящей работе охарактеризована подкожная сингенная модель ПКР Renca у мышей линии BALB/c. Проведенные эксперименты выявили значительные ограничения: низкая воспроизводимость роста опухолей, большая вариабельность между животными, отсутствие метастазов в органы-мишени, высокий уровень дистресса у мышей. Предлагается использовать ортотопическую модель ПКР Renca, Ортотопическая инокуляция клеток Renca является перспективной методикой, позволяющую достичь метастазирования, являющееся необходимым условием для изучения механизмов взаимодействия опухоли с системой гемостаза, хотя и требует дополнительных подходов для мониторинга опухолевого роста. Введение новых сингенных моделей ПКР, учитывающих молекулярно-генетическую гетерогенность данного вида онкологии, станет важным шагом для прогресса в области онкологии.
Ключевые слова: Почечно-клеточный рак, Ортотопическая модель Renca, Гемостаз
Annotation
Renal cell carcinoma (RCC) is an aggressive oncological disease that is often diagnosed at the stage of metastasis, which significantly reduces patient survival. The hemostasis system plays an active role in the processes of kidney cancer metastasis, which makes it relevant to develop in vivo animal models for studying the mechanisms of interaction of tumors with the coagulation system and platelets. Among them, the syngeneic Renca model in BALB/c mice is characterized by low cost, preservation of native immunity, and a high rate of tumorigenesis. In this work, a subcutaneous syngeneic model of Renca RCC in BALB/c mice is characterized. The experiments revealed significant limitations: low reproducibility of tumor growth, high variability between animals, absence of metastases in target organs, high level of distress in mice. It is proposed to use the orthotopic Renca RCC model. Orthotopic inoculation of Renca cells is a promising technique that allows achieving metastasis, which is a prerequisite for studying the mechanisms of tumor interaction with the hemostasis system, although it requires additional approaches for monitoring tumor growth. The introduction of new syngeneic RCC models that take into account the molecular genetic heterogeneity of this type of oncology will be an important step for progress in the field of oncology.
Key words: Renal cell carcinoma, Orthotopic Renca model, Hemostasis
Введение
Рак почки (почечно-клеточный рак, ПКР) является одним из наиболее агрессивных форм злокачественных новообразований. Во всем мире ежегодно регистрируется более 400000 новых случаев рака почки [1]. К тому же ПКР часто диагностируется уже на стадии возникновения метастатических очагов: у 20-30% первичных пациентов диагноз ставится на стадии метастазирования опухоли [2]. При метастатическом заболевании 5-летняя выживаемость составляет всего 12% [1].
Наиболее распространенным типом метастазирования является метастазирование через кровеносную систему. Существует общепринятая модель каскада метастазирования, которая включает несколько этапов: трансформация опухолевых клеток (эпителиально-мезенхимальный переход), интравазация опухолевых клеток в кровоток, циркуляция в кровотоке, экстравазация в дистальном сайте, формирование пре-метастатической ниши и, наконец, формирование дистальных метастаз [3]. Одним из ключевых игроков в данном механизме метастазирования является система гемостаза. На сегодняшний день убедительно показано, что тромбоциты крови принимают участие как в росте и развитии опухолей, так и в процессе метастазирования [4].
In vivo моделирование туморогенеза является одной из основ современных исследований в области онкологии. С помощью in vivo моделей исследуются фундаментальные аспекты развития опухолей, а также решаются прикладные задачи по тестированию новых лекарственных препаратов. Наиболее распространенными организмами для in vivo моделирование рака являются лабораторные мыши [5]. Основное разнообразие in vivo моделей рака почки у лабораторных мышей составляют GEM-модели [6], однако такие модели отличаются большой себестоимостью, низкой частотой метастазирования и высоким риском побочных эффектов у животных. Ксенографтные (PDX и CDX) in vivo модели позволяют использовать клеточные линии почечно-клеточного рака человека или же образцы опухоли конкретных пациентов, но такие модели также дорогостоящи [6]. Для исследований взаимодействий почечно-клеточного рака и системы гемостаза наиболее адекватными представляются сингенные in vivo модели. Ключевыми достоинствами сингенных моделей являются: наличие нативного иммунитета у лабораторных животных (в отличие от PDX и CDX-моделей рака, где используются животные с подавленным иммунитетом), сравнительно низкая стоимость проведения эксперимента, простота инокуляции опухолевого материала, быстрота индукции туморогенеза и быстрый ход туморогенеза [5]. Из ключевых недостатков сингенных моделей можно выделить отсутствие генетической гетерогенности в растущей опухоли, а также сложности с трансляцией результатов на организм человека. Однако, в контексте изучения механизмов взаимодействия системы гемостаза с солидными опухолями недостатки сингенных моделей рака не являются критичными. К сожалению, существует лишь одна клеточная линия почечно-клеточного рака почки мыши – Renca [6], что в совокупности с высокой молекулярно-генетической гетерогенностью рака почки делает актуальным создание новых культивируемых клеточных линий и сингенных in vivo моделей рака почки мыши.
Сингенные in vivo модели делятся на эктопические и ортотопические. Эктопические модели подразумевают инокуляцию суспензии опухолевых клеток подкожно. Такая модель отличается хорошей воспроизводимостью, простотой инокуляции опухолевого материала и наблюдения развития опухоли [6]. Однако подкожная модель Renca, как и другие подкожные сингенные модели рака не отличается высокой частотой спонтанного метастазирования [6, 7].
Ортотопическая модель рака почки Renca осуществляется путем инокуляции суспензии клеток в почку. Существует два подхода к ортотопической инокуляции: субкапсулярное введение [8, 9], или же прямое введение клеток в почку [10]. При обоих подходах ортотопической инокуляции первичная опухолевая масса постепенно растет в почке, после чего образует спонтанные метастазы. Легочные метастазы можно обнаружить на 15–20 день после субкапсулярной имплантации [11]. В модели «прямой инокуляции» микро-метастазы в легких формируются к 7 дню после имплантации, а на 23-й день в легких наблюдаются макрометастазы [10]. Значительным недостатком ортотопической модели рака почки является невозможность отслеживания динамики роста опухоли простыми методами (измерением линейных размеров штангенциркулем). Поэтому при создании ортотопической модели почки основными критериями, на которые можно полагаться для определения длительности эксперимента, являются состояние животных (индекс боль/дистресс). Оценку метастазирования опухоли в легкие можно проводить с помощью методики, описанной в [12]. С другой стороны, использование генетически-модифицированных клеток Renca, обладающих способностью к биолюминесценции, позволяет осуществлять неинвазивный мониторинг роста опухоли с помощью соответствующих систем визуализации [13].
В настоящей работе мы использовали подкожную сингенную модель почечно-клеточного рака Renca у мышей линии BALB/c для характеризации и оценки применимости модели для исследования взаимодействий системы гемостаза и опухоли.
Материалы и методы
Клеточная культура
Культура почечно-клеточного рака Renca была приобретена в РОНЦ Н.Н. им. Блохина (Москва, Россия) и поддерживалась in vitro в среде RPMI-1640 в клеточном инкубаторе при 37°С и атмосфере 95/5% воздух/углекислый газ. Для инокуляции клеток EMT-6 мышам производилась рутинная трипсинизация in vitro культуры и ресуспендирование клеток в растворе солей Хэнкса (HBSS) в концентрации 107 клеток/мл, дополнительно жизнеспособность клеточной культуры определялась с помощью трипанового голубого, для инокуляции использовались культура Renca с жизнеспособностью более 90%.
In vivo модель рака почки Renca
Для in vivo модели рака почки Renca использовались 8-9 недельные самки мышей линии BALB/c (Питомник лабораторных животных “Пущино”, г. Пущино, Россия). Животные содержались в помещении временного содержания животных ЦТП ФХФ РАН при 12-часовом цикле день/ночь, в условиях постоянной влажности и температуры 22±2°С в клетках типа T2 по 5-6 особей на клетку. Питание и доступ к питьевой воде ad libitum. За неделю до инокуляции осуществлялся хэндлинг мышей. Для подкожной инокуляции клеток Renca мышь вводились в наркоз с помощью изофлурана (ИзоНик, Vetpharma Animal Health, Испания) по «nose-cone» методике. При достижении глубокого наркоза, определяемого как отсутствие болевого рефлекса при сильном нажатии на заднюю лапку, брюхо животного смачивалось 70% раствором медицинского спирта для лучшей визуализации кожи. Затем под кожу в правую часть живота вводился шприц с иглой 26 ½ G, и 100 мкл суспензии клеток Renca (107 клеток/мл) вводилось под кожу. После инокуляции животное выводилось из наркоза и помещалось в чистую клетку. Далее 3 раза в неделю осуществлялся мониторинг состояния животных и оценка развития опухоли. С помощью штангенциркуля измерялась длина (L) и ширина опухоли (W), объем опухоли рассчитывался по формуле V = L*W2/2. На 36-38 день после инокуляции животные подвергались гуманной эвтаназии путем цервикальной дислокации, и производилась оценка наличия поверхностных метастаз в легкие и в печень. Эксперименты с животными проводились в соответствии с международными рекомендациями и были одобрены независимым этическим комитетом по биоэтике Института теоретических проблем физико-химической фармакологии РАН (Протоколы № 1 от 17.01.2023 г. и № 1 от 25.01.2024 г.).
Результаты
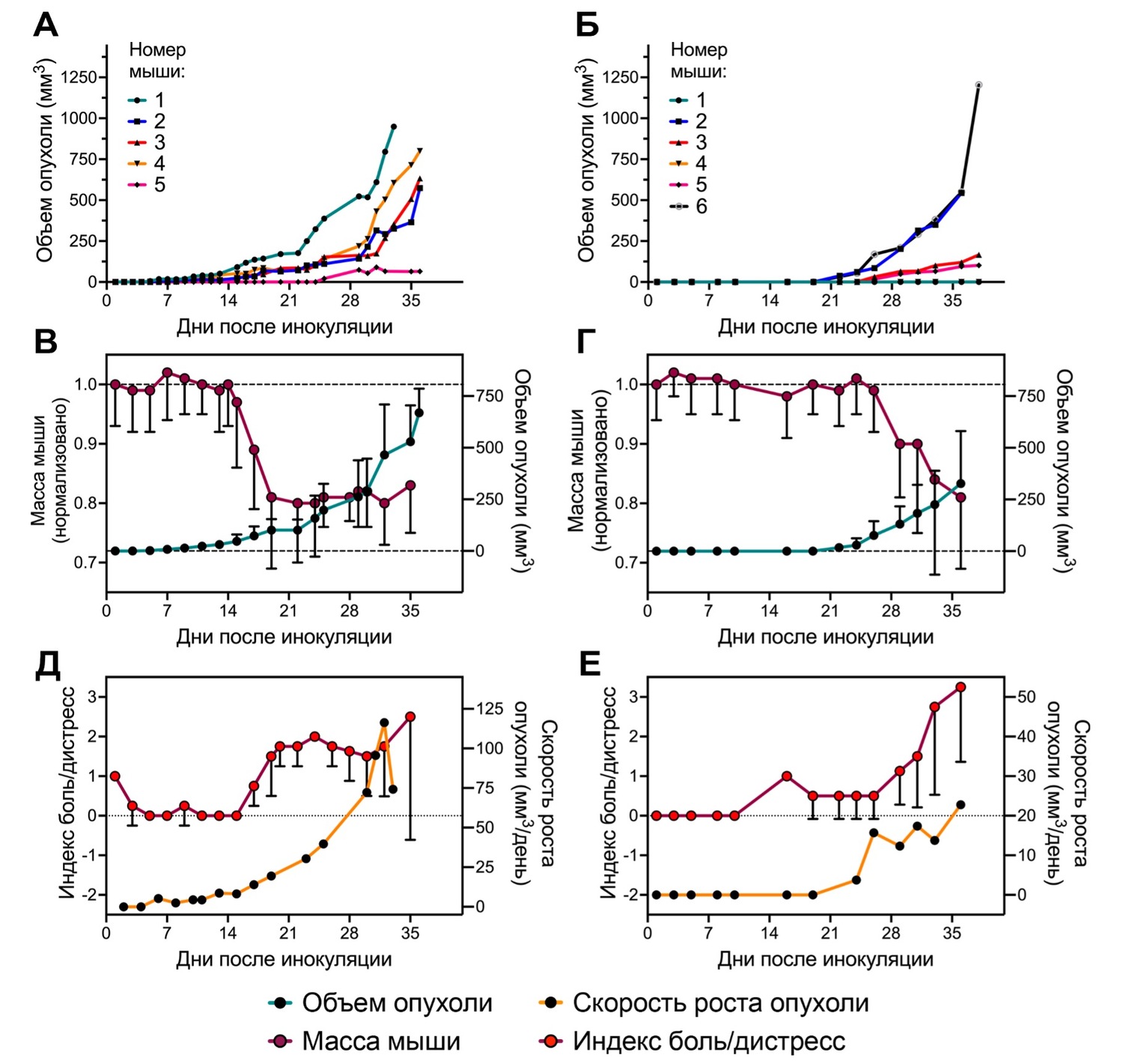
Мы провели два эксперимента по моделированию почечно-клеточного рака Renca у самок мышей линии BALB/c (Рисунок 1). По результатам двух экспериментов модель Renca показала низкую воспроизводимость во времени возникновения пальпируемых подкожных опухолей: 5-6 день для эксперимента №1 и 22-26 день для эксперимента №2, а также большую вариабельность между животными внутри эксперимента (Рис. 1А, 1Б). В эксперименте №1 у 4 мышей опухоли возникли на 5-6 день и развивались относительно однородно, у 1 мыши опухоль возникла только на 25 день. В эксперименте №2 опухоли возникли только у 4 из 6 мышей в группе. В дополнение к этому, средний размер опухолей на 33 день после инокуляции отличался в 2,5 раза для эксперимента №1 (558±289 мм3) и эксперимента №2 (225±164 мм3) (Рис. 1В, 1Г). Однако, в обоих экспериментах наблюдалось снижение массы животных с момента достижения опухолью размеров 50-100 мм3, и потеря веса происходила до окончания проведения эксперимента. В эксперименте №1 животные потеряли 17 ± 8 %, в эксперименте №2 – 19 ± 12 % от изначальной массы. Значительно отличались кинетики изменения скорости роста опухолей между экспериментами. В эксперименте №1 скорость роста опухолей экспоненциально увеличивалась, достигнув максимума в 125 мм3/день на 35 день эксперимента, в эксперименте №2 также наблюдался экспоненциальный рост скорости, но максимум составил 22 мм3/день на 35 день эксперимента (Рис. 1Д, 1Е). Также по ходу эксперимента значительно ухудшалось состояние животных, что выражалось в увеличении индекса боль/дистресс (Рис. 1Д, 1Е). Опухоли изъязвлялись, кровоточили, у животных наблюдались выраженные мимические признаки боли/дистресса, одно животное погибло в ходе проведения эксперимента №2. При некропсии дистальные метастазы в печень или легкие не были обнаружены.
Обсуждение
В нашей работе мы использовали клеточную культуру Renca для создания модели почечно-клеточного рака у мышей линии BALB/c. Сравнивая с аналогичными подкожными моделями Renca в опубликованной литературе, наша модель Renca показывает более медленную кинетику роста опухолей. Так, в публикации Tao et. al. подкожные опухоли Renca достигли размеров 600 мм3 к 18 дню после инокуляции [14], в статье Jeon et. al. опухоли выросли до 600 мм3 за 27 дней [15], в работе Reese et. al. – до 900 мм3 за 20 дней [16], в наших же экспериментах опухоли достигли среднего размера ~670 мм3 (эксперимент #1, Рис. 1В) и ~330 мм3 (эксперимент #2, Рис. 1Г) через 36-37 дней после инокуляции клеток. Возможно, более медленный рост опухолей в наших экспериментах связан с происхождением клеточной линии. В приведенных выше публикациях клеточная линия Renca была получена от банка клеточных культур ATCC (American Type Culture Collection, США), в то время как мы приобрели линию Renca в РОНЦ Н.Н. им. Блохина (Россия). Проблема отличий одних и тех же клеточных линий между источниками давно известна, и необходимо проводить дополнительное фенотипирование для точной идентификации типа клеток [17].
Высокая вариабельность роста опухолей внутри одной группы животных зависит от множества факторов. Ключевым является уровень навыков экспериментатора, который осуществляет инокуляцию опухолевого материала. От навыков экспериментатора зависит точность инокуляции опухолевого материала: сколько клеток инокулируется каждому животному и точность сайта инокуляции. Вторым важным фактором является жизнеспособность инокулируемых клеток, которая зависит от техники культивирования in vitro, а также от выживаемости клеток после инокуляции. Причем, понижение жизнеспособности культуры клеток in vitro снижает выживаемость клеток после инокуляции и дополнительно увеличивает вариабельность количества выживших клеток. Показано, что в подкожных моделях количество выживших опухолевых клеток после инокуляции может значительно отличаться, что вносит существенный вклад в вариабельность роста опухолей внутри одной группы животных [18]. Для повышения выживаемости инокулируемых опухолевых клеток, а также снижения вариабельности в количестве жизнеспособных клеток, можно использовать различные имитаторы внеклеточного матрикса опухолей (например, Matrigel®) [19].
Стоит отметить высокую тяжесть протекания туморогенеза у самих мышей. Снижение массы тела на 20 % является признаком высокого уровня дистресса у мышей [20]. С развитием опухоли наблюдались также выраженные мимические признаки боли [21]. Примечательно, что резкое снижение массы тела животных в обоих экспериментах происходило, когда опухоли достигали объема 50-100 мм3, что дает основания полагать, что данная клеточная линия Renca «агрессивна» по отношению к животным. Внезапная гибель одного животного в эксперименте #2 вполне согласуется с опубликованными данными о том, что в модели Renca возможна спонтанная гибель животных через 3-4 недели после инокуляции опухолевых клеток [22].
Таким образом низкая воспроизводимость роста опухолей между экспериментами, высокая вариабельность роста опухолей между животными, тяжесть протекания туморогенеза и отсутствие метастаз в легких делают подкожную модель Renca не пригодной для исследования механизмов взаимодействия системы гемостаза с опухолями.
Заключение
Несмотря на большое разнообразие in vivo моделей рака почки на сегодняшний день наиболее адекватной с точки зрения изучения механизмов метастазирования являются классические старые сингенные модели. Поскольку лабораторные мыши являются золотым стандартом в in vivo моделировании рака, но при этом для рака почки по сути существует только одна сингенная модель (Renca), актуальной задачей является разработка новых сингенных моделей рака почки, в которых будут использоваться другие линии почечно-клеточного рака, с отличными от Renca молекулярно-генетическими и морфологическими признаками.
Вклад авторов
А.А.М. – проведение экспериментов, написание статьи
Благодарности
Автор выражает благодарность Колесниковой И.С. за помощь в культивировании клеточной линии Renca.
Финансирование
Это исследование финансировалось Российским Научным Фондом, номер гранта 23-45-10039.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов
Рисунки
Рисунок 1. Подкожная in vivo модель рака почки Renca у мышей BALB/c. Кинетики роста опухолей у отдельных мышей в эксперименте #1 (А) и #2 (Б); Кинетики усредненного роста опухолей и изменения средней массы мышей в эксперименте #1 (В) и #2 (Г); Кинетики изменения среднего индекса боль/дистресс и средней скорости роста опухолей в эксперименте #1 (Д) и #2 (Е). Средние значения ± SD, для усреднения взяты мыши 1-4 в эксперименте #1 и мыши 2,3,4,6 в эксперименте #2.
Список литературы
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clinicians 68:394–424. https://doi.org/10.3322/caac.21492
2. Jonasch E, Gao J, Rathmell WK (2014) Renal cell carcinoma. BMJ 349:g4797–g4797. https://doi.org/10.1136/bmj.g4797
3. Lambert AW, Pattabiraman DR, Weinberg RA (2017) Emerging Biological Principles of Metastasis. Cell 168:670–691. https://doi.org/10.1016/j.cell.2016.11.037
4. Sveshnikova AN, Tesakov IP, Kuznetsova SA, Shamova ЕМ (2024) Role of Platelet Activation in the Development and Metastasis of Solid Tumors. J Evol Biochem Phys 60:211–227. https://doi.org/10.1134/S0022093024010150
5. Bokova UA, Tretyakova MS, Schegoleva AA, Denisov EV (2023) In vivo models in cancer research. Usp mol onkol 10:8–16. https://doi.org/10.17650/2313-805X-2023-10-2-8-16
6. Sobczuk P, Brodziak A, Khan MI, Chhabra S, Fiedorowicz M, Wełniak-Kamińska M, Synoradzki K, Bartnik E, Cudnoch-Jędrzejewska A, Czarnecka AM (2020) Choosing The Right Animal Model for Renal Cancer Research. Translational Oncology 13:100745. https://doi.org/10.1016/j.tranon.2020.100745
7. Khanna C (2004) Modeling metastasis in vivo. Carcinogenesis 26:513–523. https://doi.org/10.1093/carcin/bgh261
8. Matin SF, Sharma P, Gill IS, Tannenbaum C, Hobart MG, Novick AC, Finke JH (2010) Immunological Response to Renal Cryoablation in an In Vivo Orthotopic Renal Cell Carcinoma Murine Model. Journal of Urology 183:333–338. https://doi.org/10.1016/j.juro.2009.08.110
9. Braga MDS, Chaves KB, Chammas R, Schor N, Bellini MH (2012) Endostatin neoadjuvant gene therapy extends survival in an orthotopic metastatic mouse model of renal cell carcinoma. Biomedicine & Pharmacotherapy 66:237–241. https://doi.org/10.1016/j.biopha.2011.11.002
10. Murphy KA, James BR, Wilber A, Griffith TS (2017) A Syngeneic Mouse Model of Metastatic Renal Cell Carcinoma for Quantitative and Longitudinal Assessment of Preclinical Therapies. JoVE 55080. https://doi.org/10.3791/55080
11. Dybal EJ, Haas GP, Maughan RL, Sud S, Pontes JE, Hillman GG (1992) Synergy of Radiation Therapy and Immunotherapy in Murine Renal Cell Carcinoma. Journal of Urology 148:1331–1337. https://doi.org/10.1016/S0022-5347(17)36903-3
12. Mendoza A, Gharpure R, Dennis J, Webster JD, Smedley J, Khanna C (2013) A novel noninvasive method for evaluating experimental lung metastasis in mice. J Am Assoc Lab Anim Sci 52:584–589
13. Ding J, Wang C, Chang X (2018) Establishment of a bioluminescent Renca cell line for renal carcinoma research. Int Urol Nephrol 50:55–61. https://doi.org/10.1007/s11255-017-1707-7
14. Tao R, Niu W, Dou P, Ni S, Yu Y, Cai L, Wang X, Li S, Zhang C, Luo Z (2020) Nucleobindin‑2 enhances the epithelial‑mesenchymal transition in renal cell carcinoma. Oncol Lett. https://doi.org/10.3892/ol.2020.11526
15. Jeon Y, Kang H, Yang Y, Park D, Choi B, Kim J, Kim J, Nam K (2022) A Novel Selective Axl/Mer/CSF1R Kinase Inhibitor as a Cancer Immunotherapeutic Agent Targeting Both Immune and Tumor Cells in the Tumor Microenvironment. Cancers 14:4821. https://doi.org/10.3390/cancers14194821
16. Reese B, Silwal A, Daugherity E, Daugherity M, Arabi M, Daly P, Paterson Y, Woolford L, Christie A, Elias R, Brugarolas J, Wang T, Karbowniczek M, Markiewski MM (2020) Complement as Prognostic Biomarker and Potential Therapeutic Target in Renal Cell Carcinoma. The Journal of Immunology 205:3218–3229. https://doi.org/10.4049/jimmunol.2000511
17. Souren NY, Fusenig NE, Heck S, Dirks WG, Capes‐Davis A, Bianchini F, Plass C (2022) Cell line authentication: a necessity for reproducible biomedical research. The EMBO Journal 41:e111307. https://doi.org/10.15252/embj.2022111307
18. Hoffmann B, Lange T, Labitzky V, Riecken K, Wree A, Schumacher U, Wedemann G (2020) The initial engraftment of tumor cells is critical for the future growth pattern: a mathematical study based on simulations and animal experiments. BMC Cancer 20:524. https://doi.org/10.1186/s12885-020-07015-9
19. Fridman R, Benton G, Aranoutova I, Kleinman HK, Bonfil RD (2012) Increased initiation and growth of tumor cell lines, cancer stem cells and biopsy material in mice using basement membrane matrix protein (Cultrex or Matrigel) co-injection. Nat Protoc 7:1138–1144. https://doi.org/10.1038/nprot.2012.053
20. Talbot SR, Biernot S, Bleich A, Van Dijk RM, Ernst L, Häger C, Helgers SOA, Koegel B, Koska I, Kuhla A, Miljanovic N, Müller-Graff F-T, Schwabe K, Tolba R, Vollmar B, Weegh N, Wölk T, Wolf F, Wree A, Zieglowski L, Potschka H, Zechner D (2020) Defining body-weight reduction as a humane endpoint: a critical appraisal. Lab Anim 54:99–110. https://doi.org/10.1177/0023677219883319
21. Langford DJ, Bailey AL, Chanda ML, Clarke SE, Drummond TE, Echols S, Glick S, Ingrao J, Klassen-Ross T, LaCroix-Fralish ML, Matsumiya L, Sorge RE, Sotocinal SG, Tabaka JM, Wong D, Van Den Maagdenberg AMJM, Ferrari MD, Craig KD, Mogil JS (2010) Coding of facial expressions of pain in the laboratory mouse. Nat Methods 7:447–449. https://doi.org/10.1038/nmeth.1455
22. Salup RR, Herberman RB, Wiltrout RH (1985) Role of Natural Killer Activity in Development of Spontaneous Metastases in Murine Renal Cancer. Journal of Urology 134:1236–1241. https://doi.org/10.1016/S0022-5347(17)47702-0