Кальциевая сигнализация регулирует ретракцию ламеллиподий в хемотактирующих нейтрофилах человека
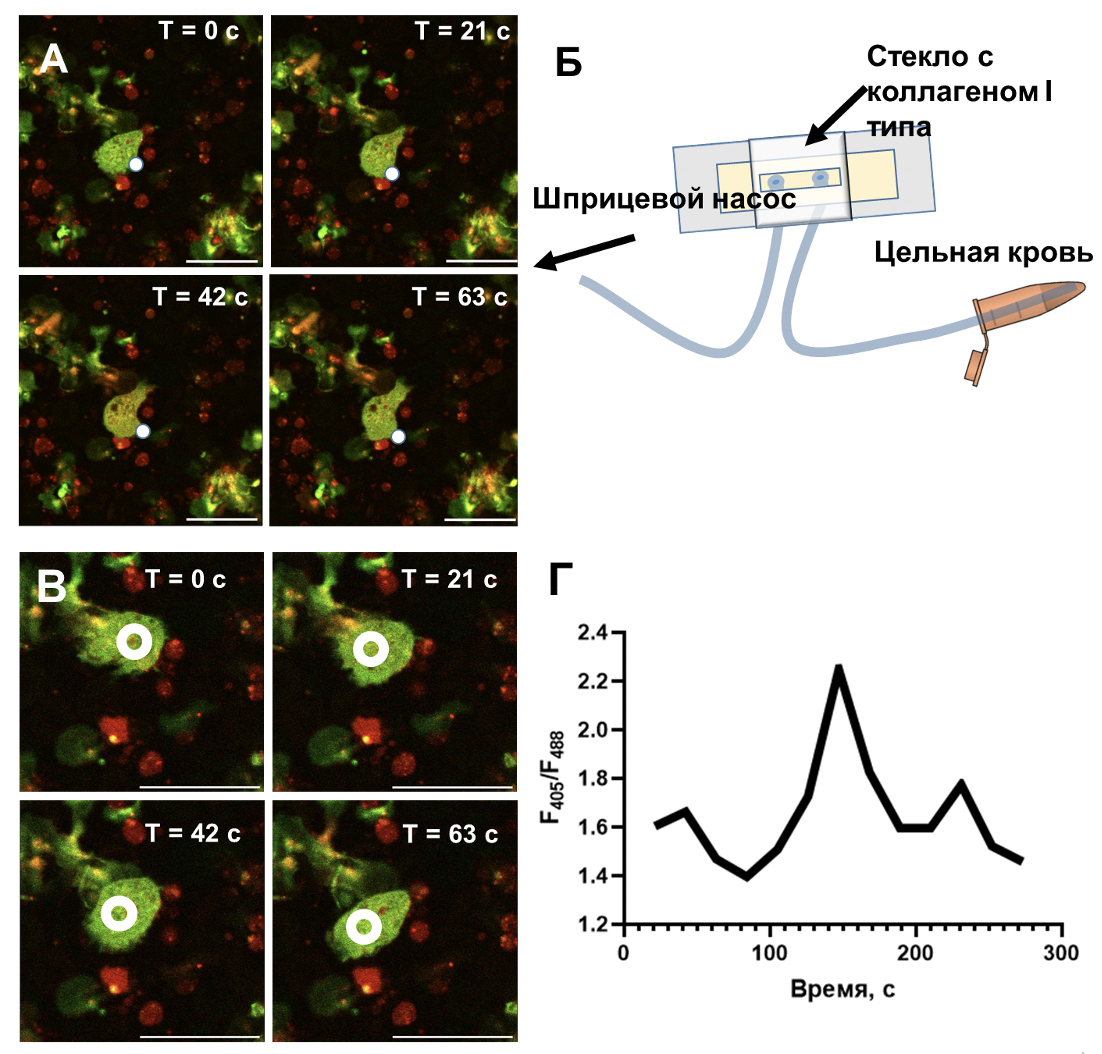
Рисунок 1. Методы наблюдения кальциевой сигнализации в нейтрофилах, движущихся вокруг растущего тромба. (А) Типичное изображение растущей ламеллиподии нейтрофила. Белой точкой показан край растущей ламеллиподии. Шкала 20 мкм. (Б) Схема эксперимента: цельная кровь, окрашенная флуоресцентной меткой Fura RED, прокачивалась через плоско-параллельную проточную камеру в течение 30 минут. (В) Пример области, в котором измерялась флуоресценция Fura RED (белый круг). Шкала 20 мкм. (Г) Типичный вид динамики концентрации кальция (F405/F488) для одиночного нейтрофила.
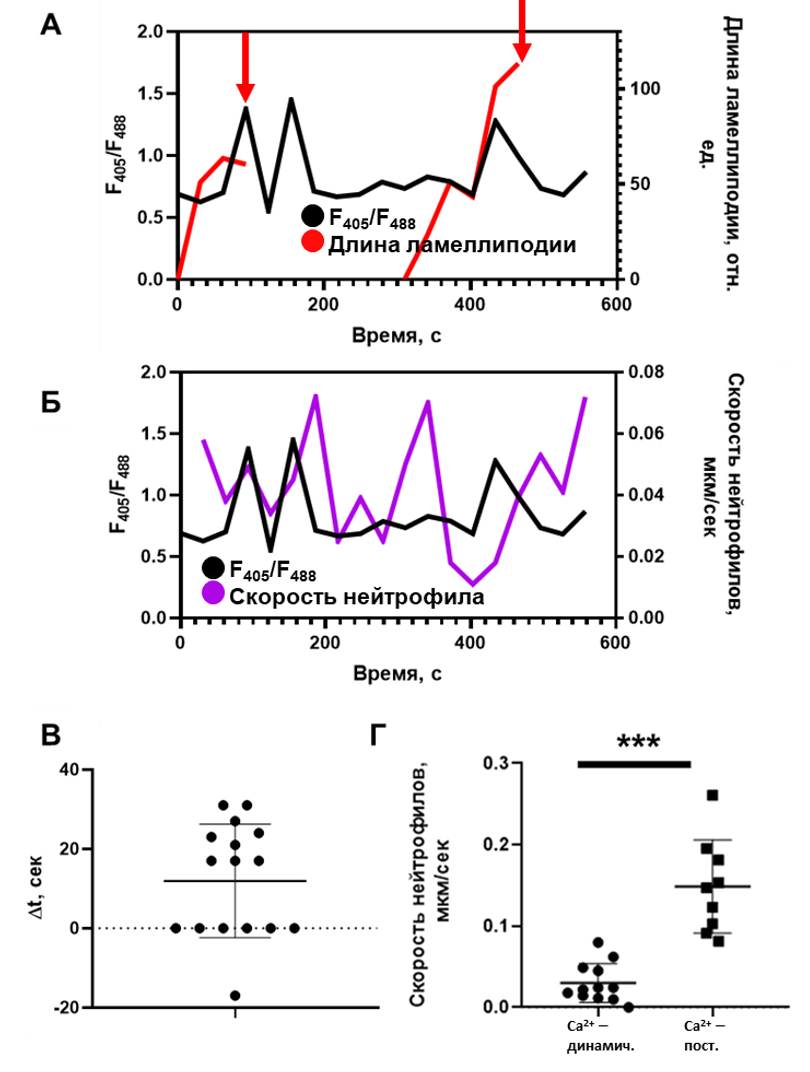
Рисунок 2. Экспериментально наблюдаемый кальциевый ответ в нейтрофилах не влияет на подвижность клеток, но регулирует ретракцию ламеллиподий. А. Типичный кальциевый ответ в движущемся нейтрофиле. Ретракция ламеллиподий (красная стрелка) сопадает по времени с пиком концентрации кальция. На графике представлен типичный ответ из N = 16 событий ретракции ламеллиподий из 12 проанализированных клеток для 3 здоровых доноров. Б. В типичном нейтрофиле кальциевый ответ не коррелирует с подвижностью нейтрофила. На графике представлен типичный ответ из N = 12 проанализированных клеток для 3 здоровых доноров. В. Временная задержка между ретракцией ламеллиподии и ближайшим по времени кальциевым пиком. С помощью критерия Уилкоксона (p = 0,03) показано, что временная задержка не распределена нормально со средним Δt = 0 сек. Г. Скорости нейтрофилов, в которых уровень кальция постоянен, значительно выше, чем в клетках, в которых наблюдается динамический кальциевый ответ.
Проанализировано N = 21 клеток для 3 здоровых доноров. *** - p<0,001. Статистическая значимость рассчитана с помощью теста Манна-Уитни.
Имитация внеклеточного матрикса на основе полимеров для создания модели микроокружения опухоли
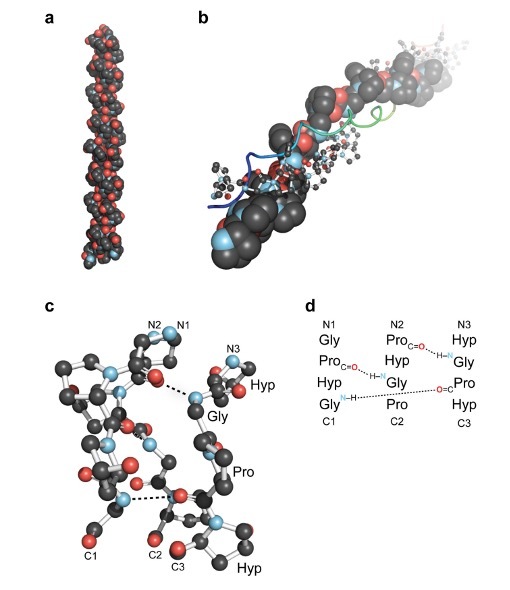
Рисунок 1. Обзор тройной спирали коллагена. (a) Первая кристаллическая структура высокого разрешения тройной спирали коллагена, образованной из (ProHypGly)4-(ProHypAla) (ProHypGly). (b) Вид по оси тройной спирали (ProProGly) с тремя нитями, изображенными в виде заполнения пространства, шара и палочки, а также ленты. (c) Изображение сегмента тройной спирали коллагена в виде шарика и палочки, подчеркивающее лестницу межнитевых водородных связей. (d) Поэтапное расположение трех нитей в сегменте на панели c [9].
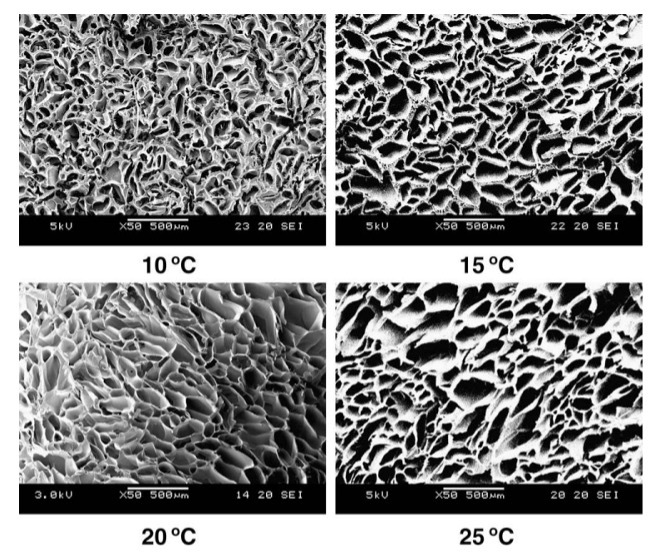
Рисунок 2. SEM-структура скаффолдов, сшитых при разных температурах. Зависимость размера пор от температуры образования: при увеличении температуры полимеризации растер размер пор [32].
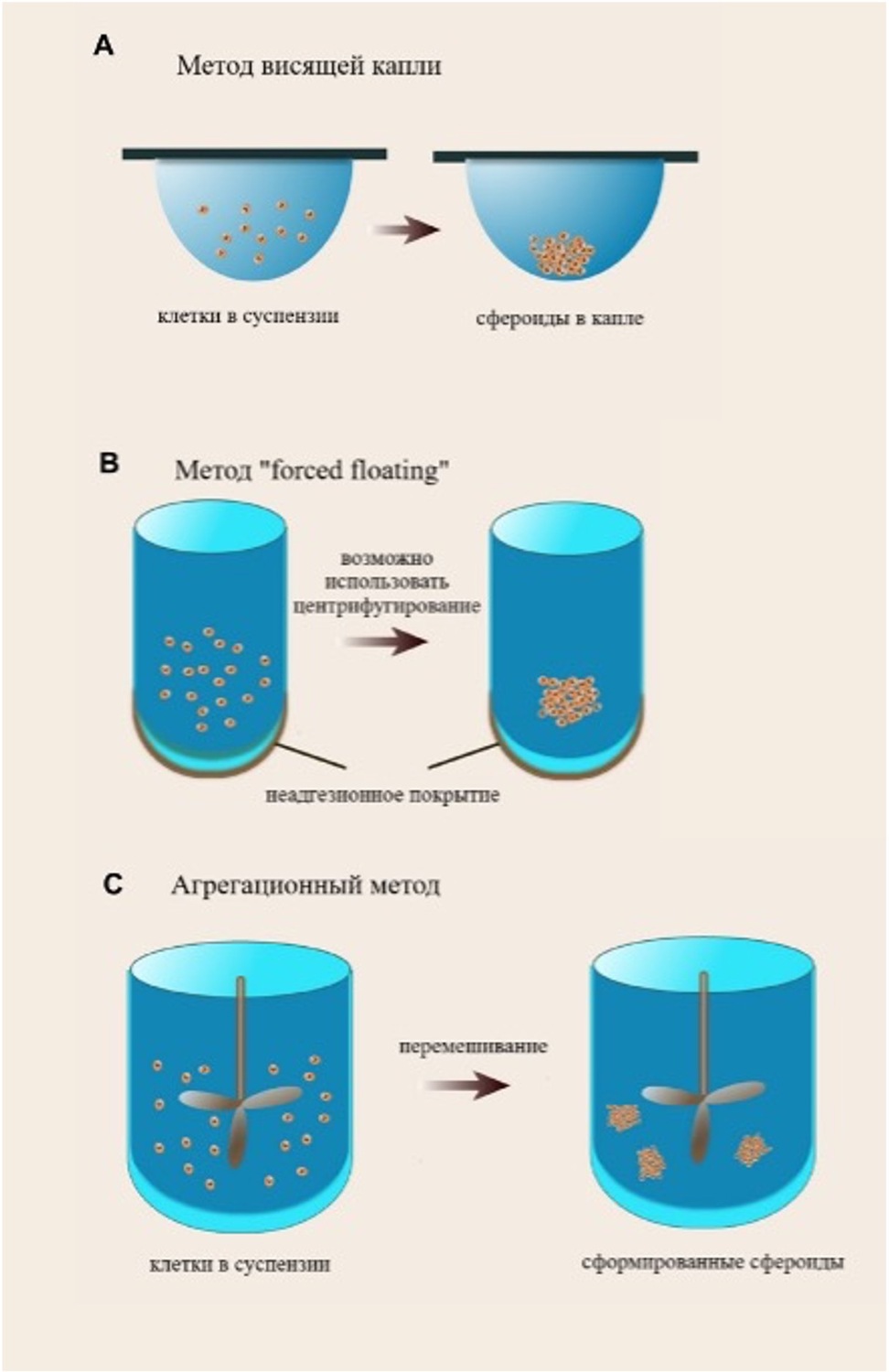
Рисунок 3. Методы формирования клеточных сфероидов [56].

Формула 1.
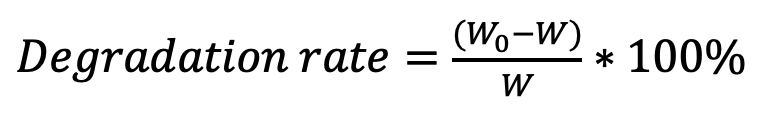
Формула 2.
Взаимодействие протромбина с субпопуляциями активированных тромбоцитов

Рисунок 1. Связывание протромбина с субпопуляции активированных тромбоцитов. На рисунке приведены типичные точечные диаграммы. А – выделение региона тромбоцитов по прямому и боковому светорассеянию. Б- связывание протромбина с популяциями активированных тромбоцитов до исключения из рассмотрения агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показана субпопуляция ФС-положительных тромбоцитов, красным -ФС-отрицательных тромбоцитов, синим – события с высоким связыванием протромбина в регионе ФС-отрицательных тромбоцитов. В- выделение агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показаны тромбоциты, окрашенные кальцеином, красным – окрашенные FuraRed, синим – события окрашенные и кальцеином, и FuraRed. Г - связывание протромбина с популяциями активированных тромбоцитов после исключения из рассмотрения агрегатов ФС-положительных и ФС-отрицательных тромбоцитов. Зеленым показана субпопуляция ФС-положительных тромбоцитов, красным -ФС-отрицательных тромбоцитов, синим – события с высоким связыванием протромбина в регионе ФС-отрицательных тромбоцитов. Представлены результаты типичного эксперимента из трех, проведенных с кровью разных доноров.
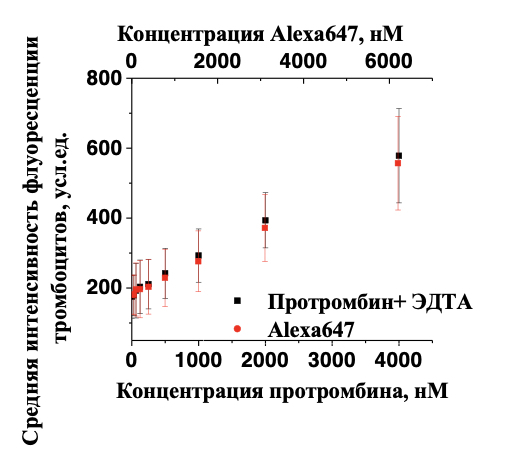
Рисунок 2. Неспецифическое взаимодействие флуорофора с активированными тромбоцитами. Черным цветом показано связывание протромбина-Alexa647 с активированными тромбоцитами в присутствии ЭДТА. Красным показано взаимодействие флуорофора Alexa647 активированными тромбоцитами.
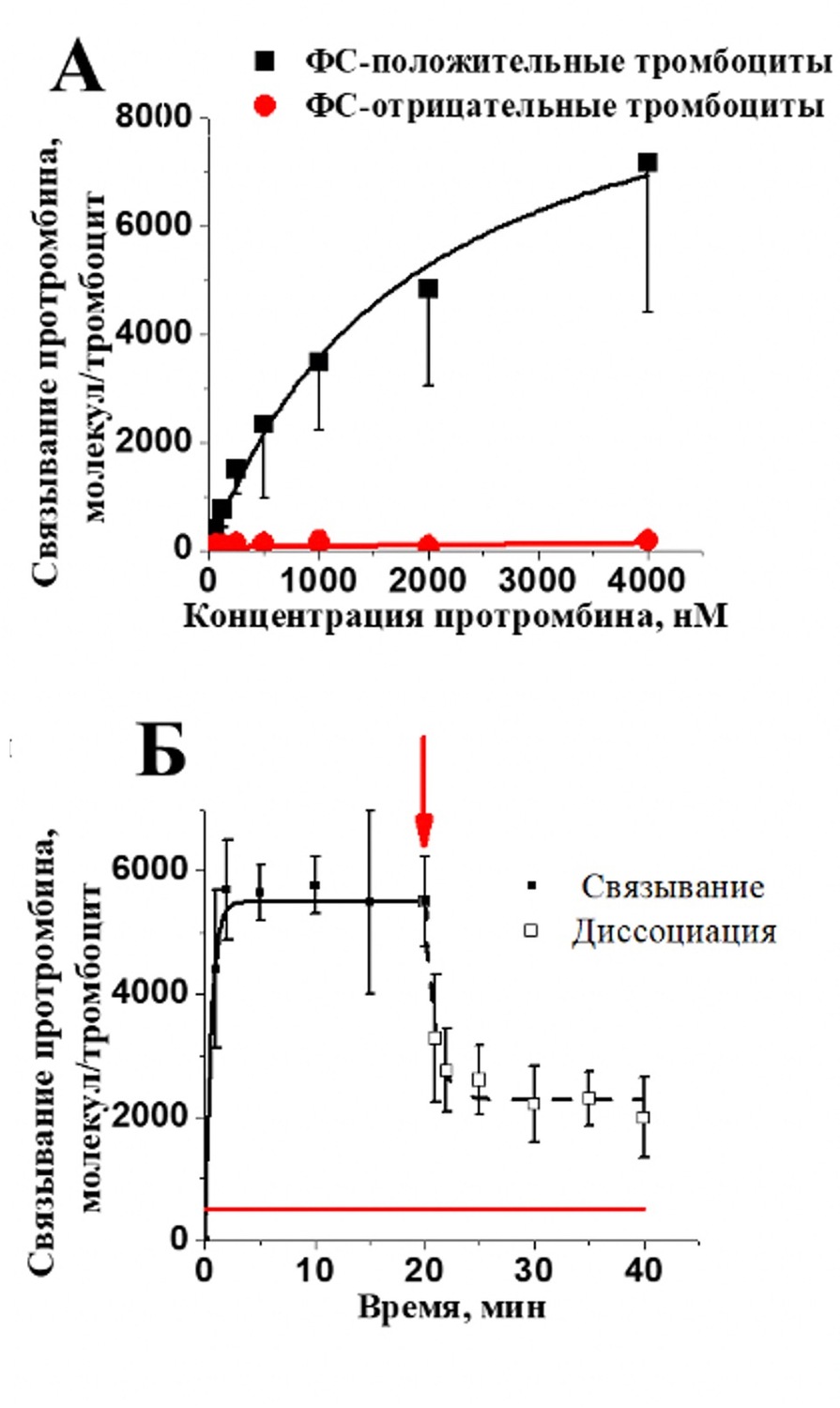
Рисунок 3. Связывание протромбина с субпопуляции активированных тромбоцитов. А – равновесное связывание с ФС-положительными (черная кривая) и ФС-отрицательными (красная кривая) тромбоцитами. Связывание оценивали методом проточной цитометрии. На графике приведены средние±SD (n=3). Б - кинетика связывания и диссоциации протромбина-Alexa647 с фосфатидилсерин положительными тромбоцитами. Связывание протромбина-Alexa647 анализировали с помощью проточного цитометра в моменты времени: 0; 1; 2; 5; 10; 15; 20 минут после добавления белка. После достижения насыщения, образцы разводили в 20 раз буфером Тироде с CaCl2 (2,5 мМ), для анализа диссоциации белка. На графиках приведены средние±SD (n=4).
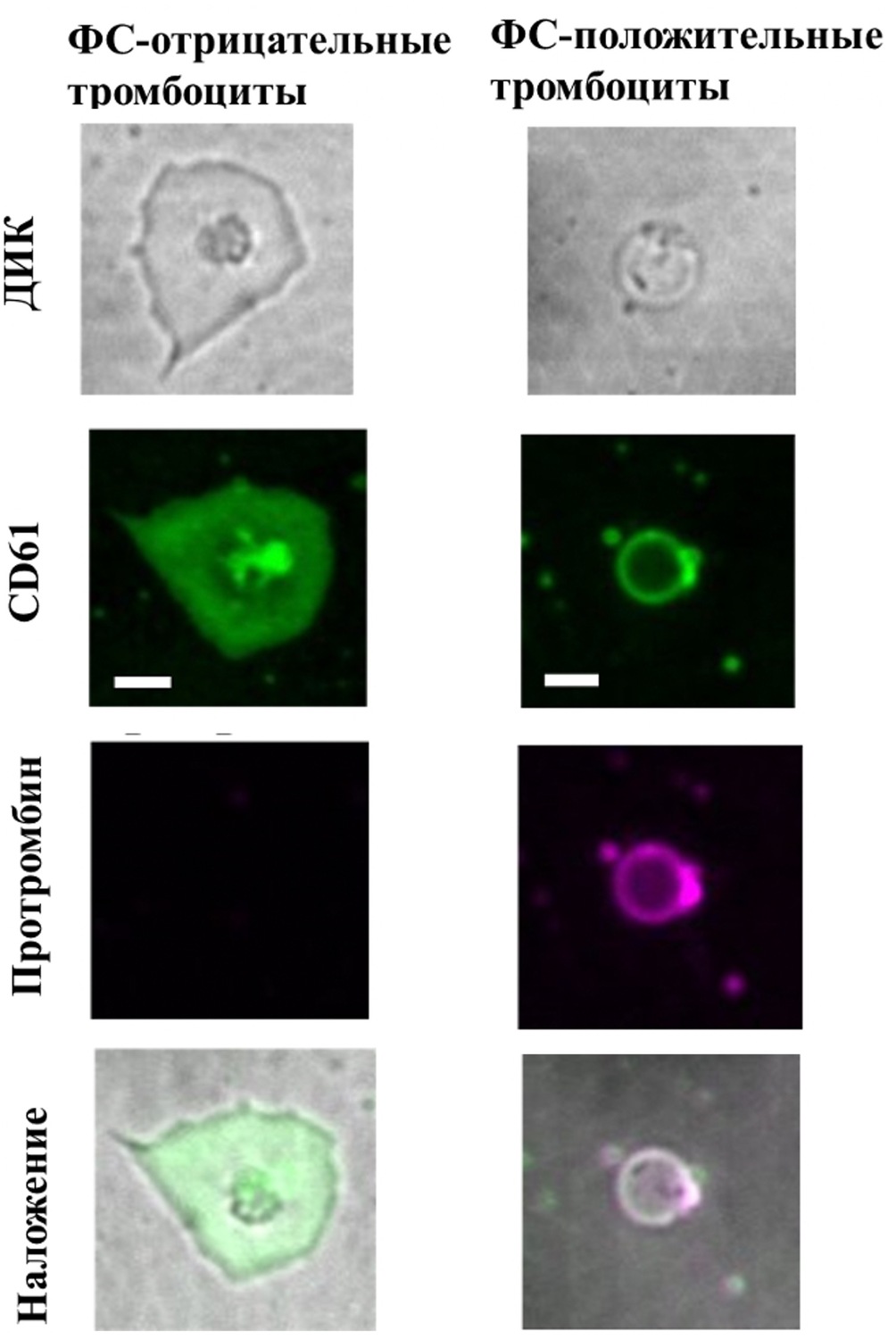
Рисунок 4. Распределение флуоресцентно меченного протромбина на мембране активированных тромбоцитов. Типичные микрофотографии активированных тромбоцитов. Зеленым показана флуоресценция CD61-ФИТЦ, пурпурным - флуоресценция Alexa647-ФII. В первом ряду показаны ФС-отрицательные тромбоциты, во втором ФС-положительные. Приведенный масштаб соответствует 3 мкм.
Характеризация подкожной in vivo модели почечно-клеточного рака Renca у мышей линии BALB/c
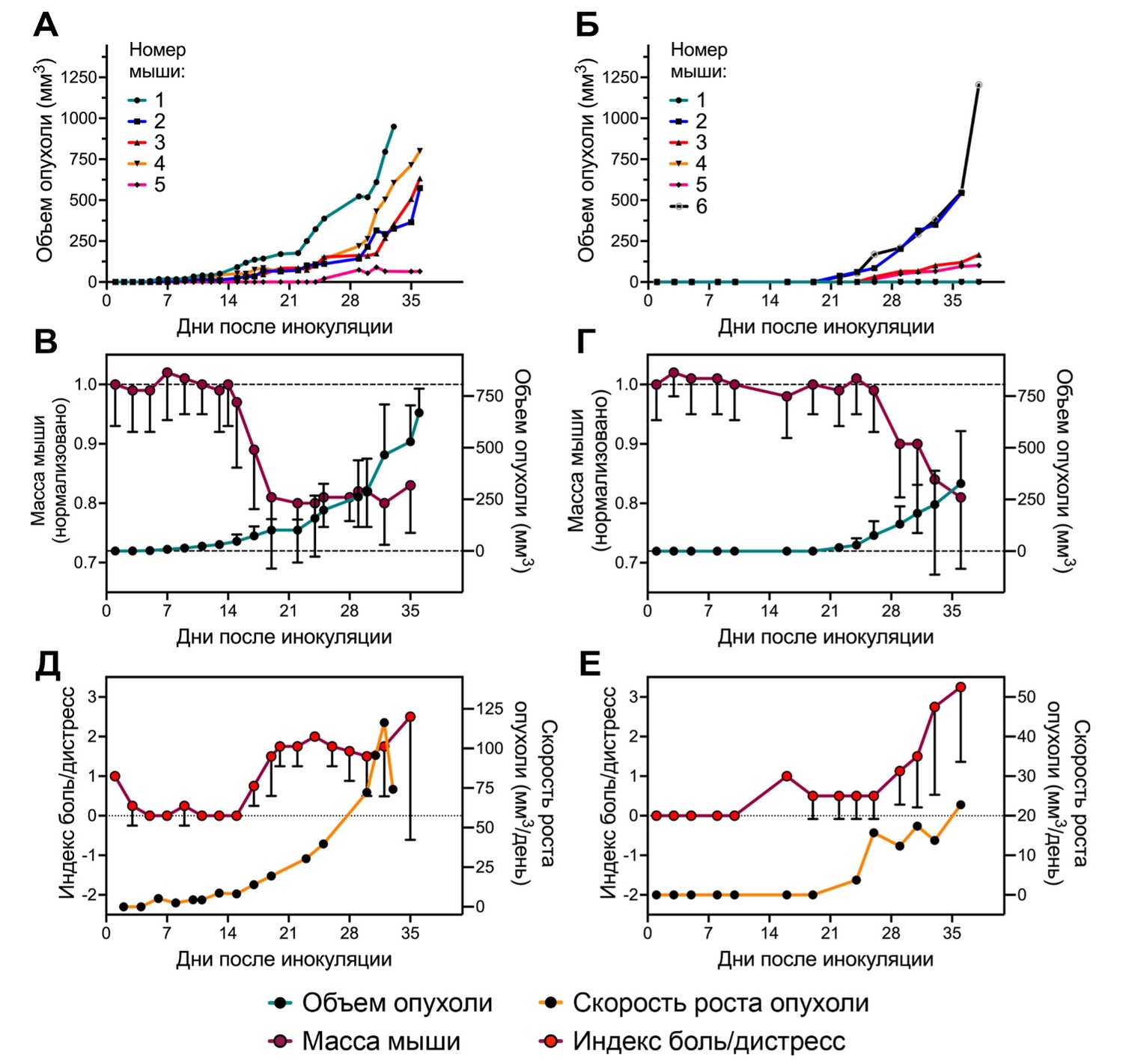
Рисунок 1. Подкожная in vivo модель рака почки Renca у мышей BALB/c. Кинетики роста опухолей у отдельных мышей в эксперименте #1 (А) и #2 (Б); Кинетики усредненного роста опухолей и изменения средней массы мышей в эксперименте #1 (В) и #2 (Г); Кинетики изменения среднего индекса боль/дистресс и средней скорости роста опухолей в эксперименте #1 (Д) и #2 (Е). Средние значения ± SD, для усреднения взяты мыши 1-4 в эксперименте #1 и мыши 2,3,4,6 в эксперименте #2.
Моделирование светорассеяния на одиночном тромбоците и их агрегатах.
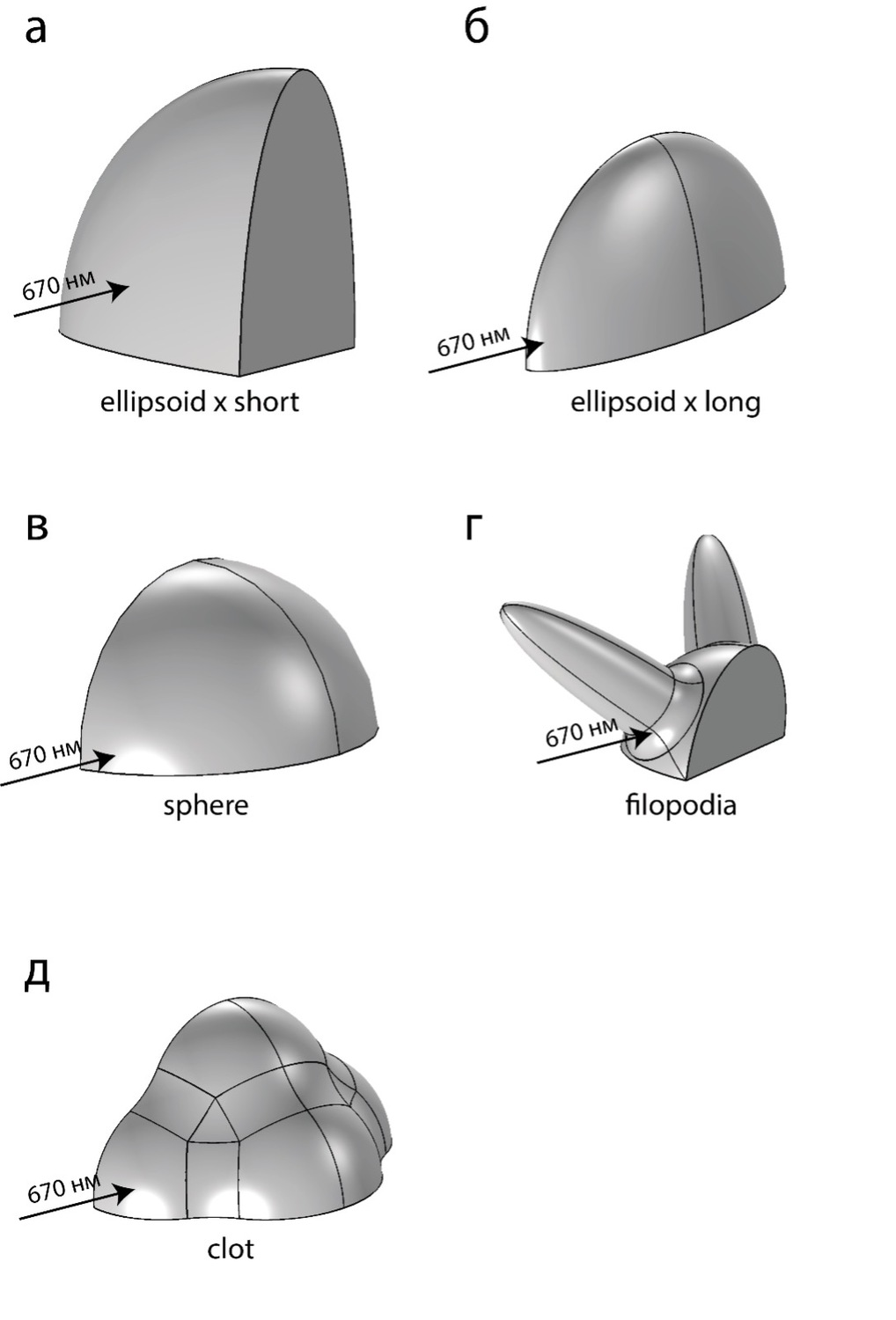
Рисунок 1. Четверти трёхмерных моделей тромбоцита/тромба. (А) ellipsoid x short – тромбоцит находится в состоянии покоя. Луч света от источника параллелен короткой оси тромбоцита. (Б) ellipsoid x long – тромбоцит находится в состоянии покоя. Луч света от источника параллелен длинной оси тромбоцита. Случаи (а) и (б) отличаются только ориентацией объекта в пространстве, клетка повернута на 90 градусов. (В) sphere – тромбоцит начал активацию и стал шаром. (Г) filopodia – тромбоцит, выпустивший филоподии. (Д) clot – агрегат из 6 клеток.
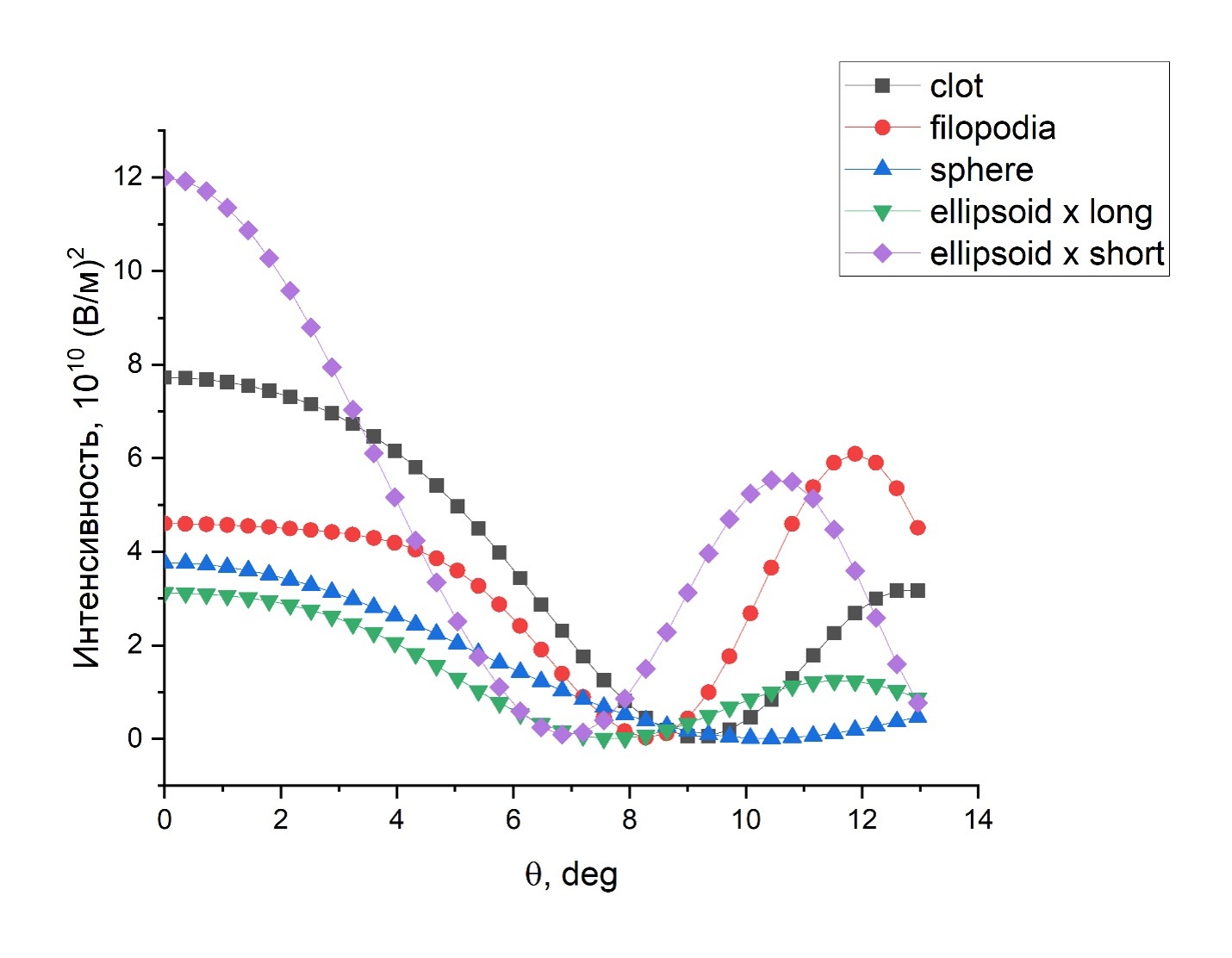
Рисунок 2. Диаграммы направленности дальнего электрического поля при малых углах для агрегата (черная линия, clot), ошаренного тромбоцита (синяя линия, sphere), тромбоцита выпустившего филоподии (красная линия, filopodia), неактивированного тромбоцита в форме эллипсоида, когда луч света направлен параллельно длинной (зеленая линия, ellipsoid x long) или короткой оси (фиолетовая линия, ellipsoid x short)
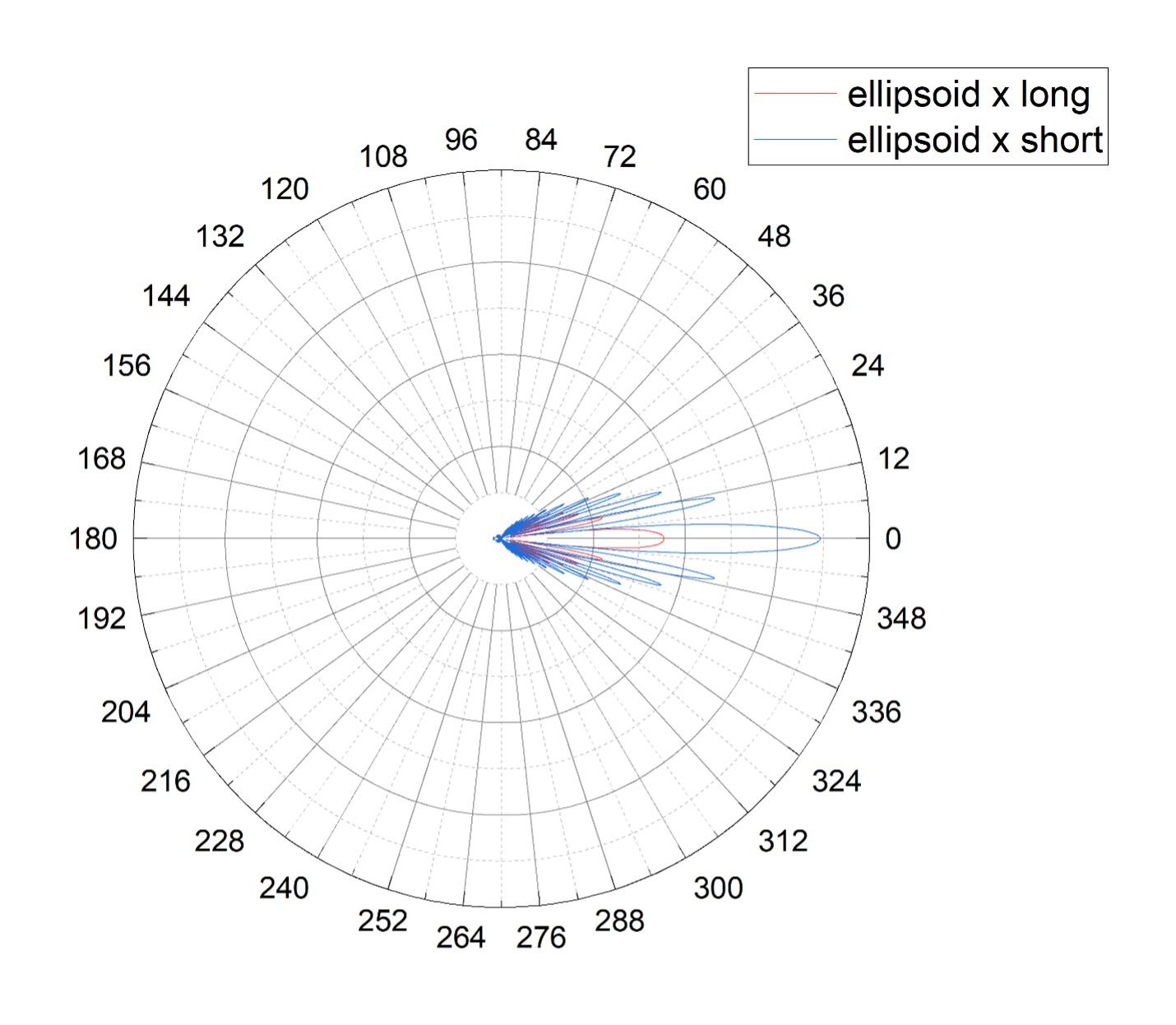
Рисунок 3. Диаграммы направленности для двух ориентаций покоящегося тромбоцита: свет направлен параллельно короткой (синяя линия, ellipsoid x short) или длинной (красная линия, ellipsoid x long) оси эллипсоида.
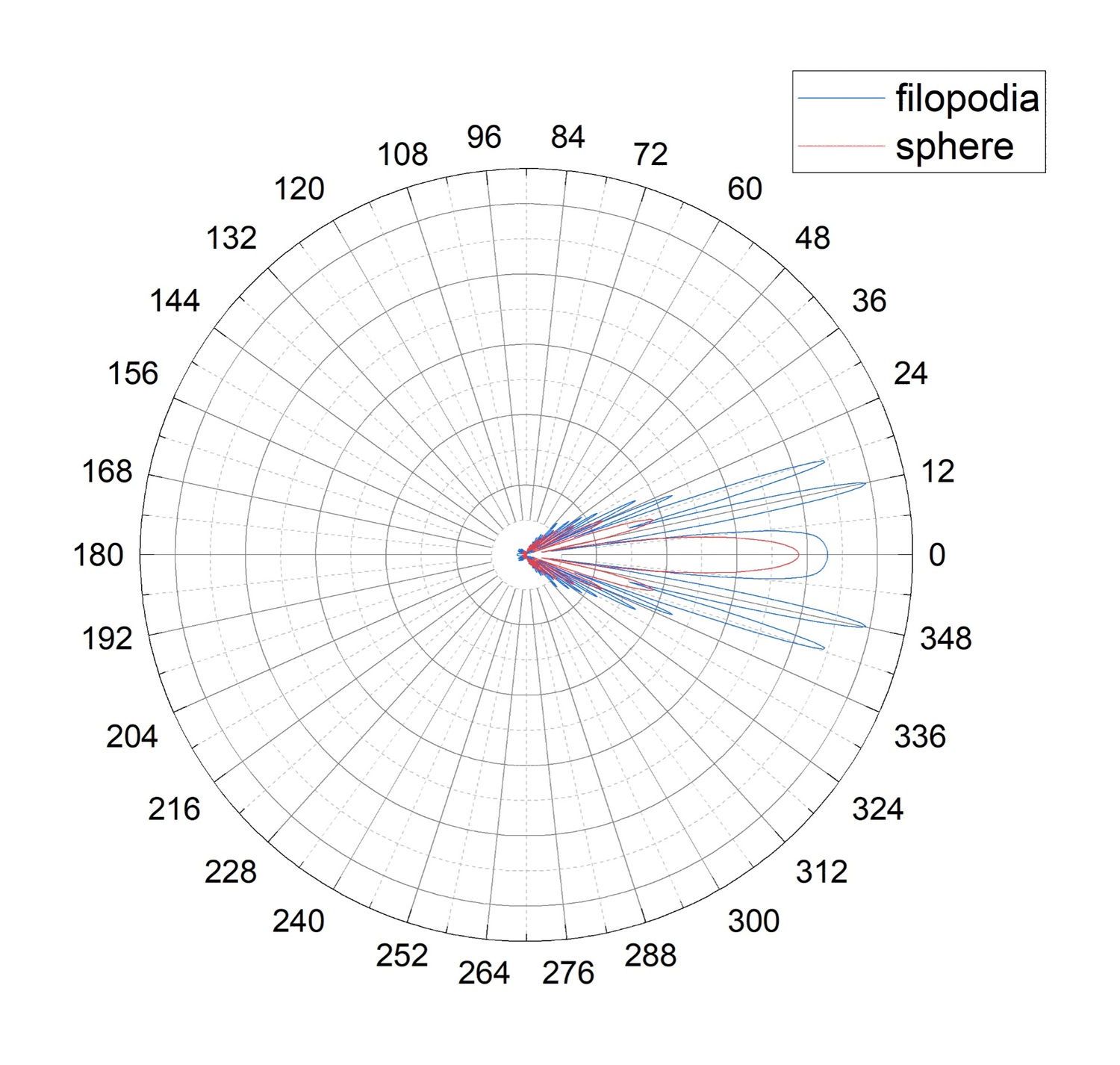
Рисунок 4. Диаграммы направленности для двух активированных состояний тромбоцита: выпустившего филоподии (обозначено синим цветом, filopodia) или ошаренного (обозначенного красным цветом, sphere)
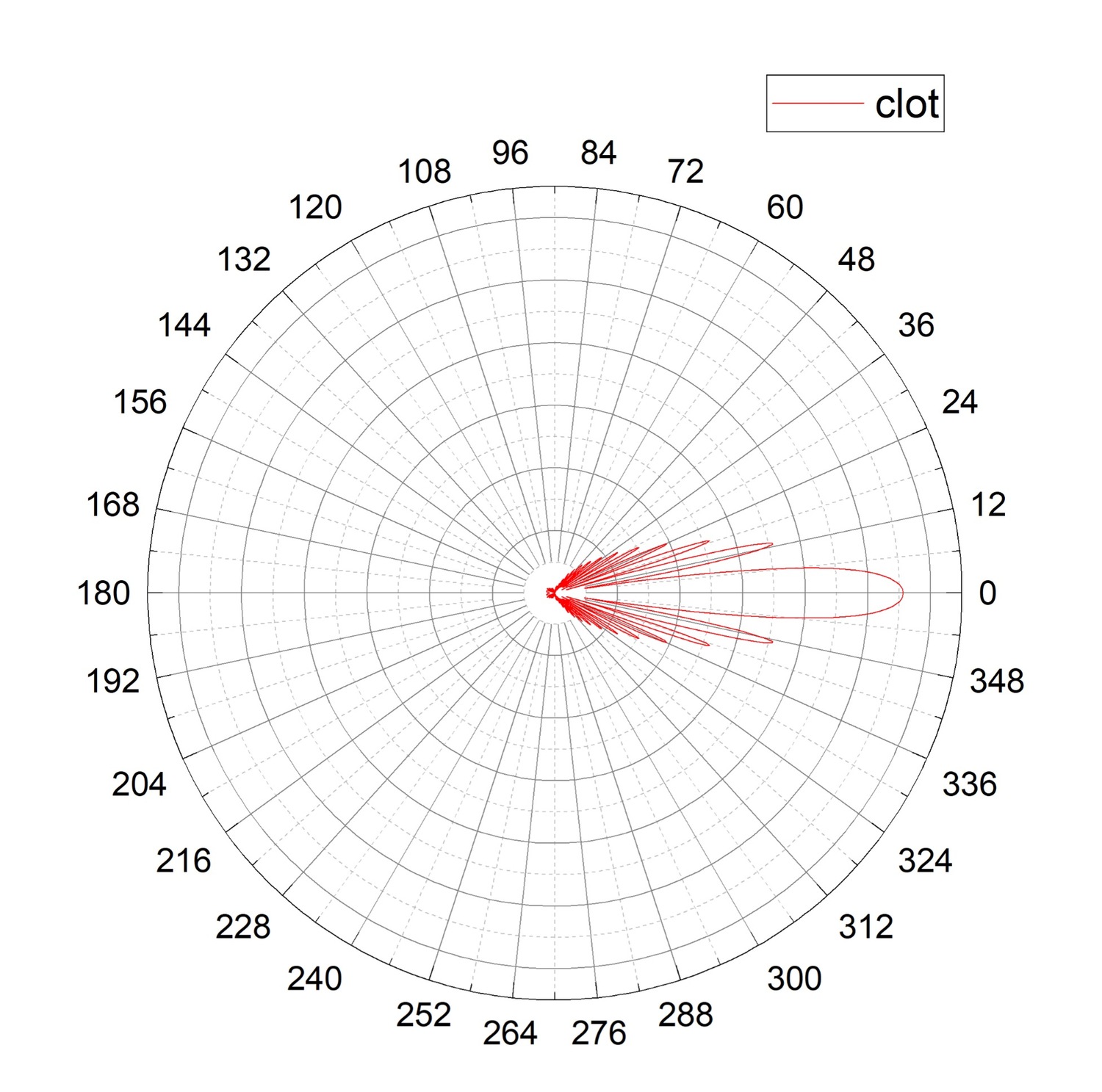
Рисунок 5. Диаграммы направленности для агрегата из тромбоцитов (гексамера, красная линия, clot). Максимальный уровень светорассеяния приходится на 0°
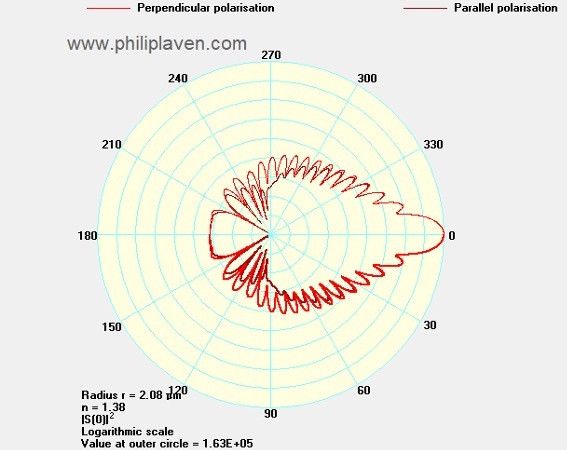
Рисунок 6. Зависимость интенсивности светорассеяния от угла в полярных координатах для перпендикулярно (обозначено красным) и параллельно (обозначено бордовым) поляризованного света. Угловое разрешение - 0.1, радиус сферы 2.08 мкм. Показатель преломления объекта - 1.38. Показатель преломления среды 1.33.
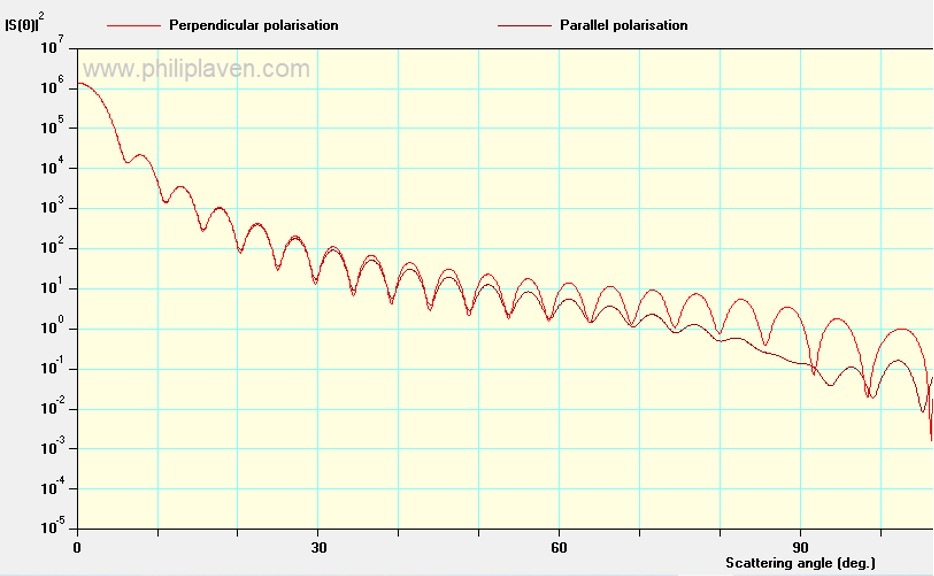
Рисунок 7. Зависимость интенсивности светорассеяния от угла в полярных координатах для перпендикулярно (обозначено красным) и параллельно (обозначено бордовым) поляризованного света. Угловое разрешение - 0.1, радиус сферы 3.12 мкм. Показатель преломления объекта -1.38. Показатель преломления среды 1.33
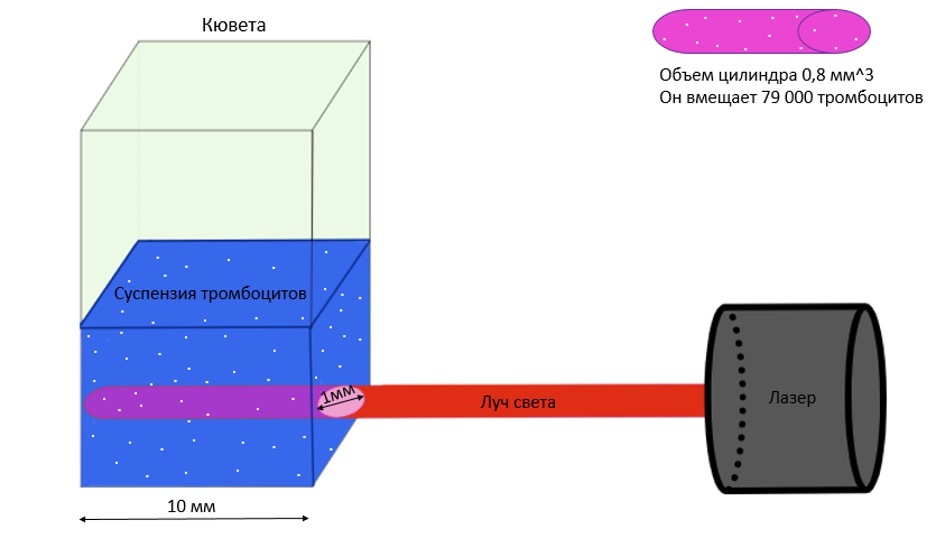
Рисунок 8. Лазер освещает цилиндрический сегмент объемом 0.8 мм3, в котором расположено 79 000 одиночных тромбоцитов.
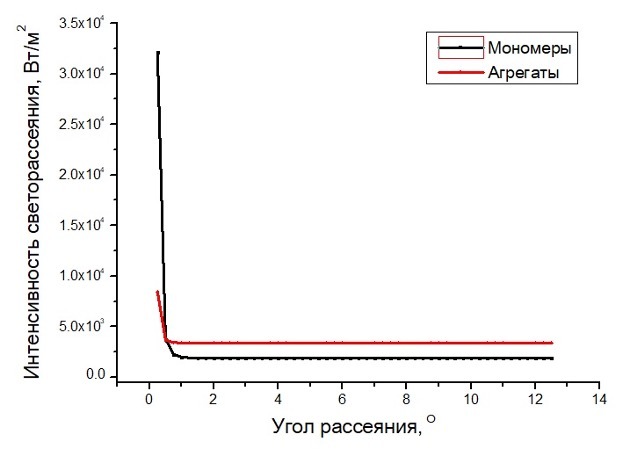
Рисунок 9. Индикатриса рассеяния в среде, содержащей суспензию тромбоцитов (черная кривая) и агрегатов тромбоцитов (красная кривая), рассчитанная аналитически с помощью среды Visual Studio Code v1.85.2 (Microsoft Corporation).

Рисунок 10. Интенсивность светорассеяния на 1° линейно убывает с увеличением концентрации рассеивающих объектов. Черная линия отображает зависимость для тромбоцитов-мономеров, красная – для агрегатов. Индикатриса рассеяния в среде, содержащей суспензию агрегатов тромбоцитов, рассчитана аналитически с помощью среды Visual Studio Code v1.85.2 (Microsoft Corporation).
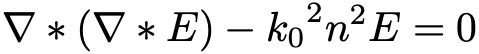
Формула 1.
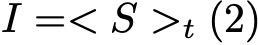
Формула 2.
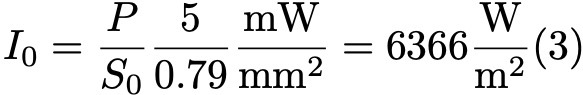
Формула 3.
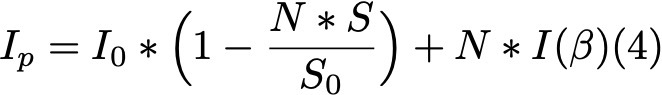
Формула 4.
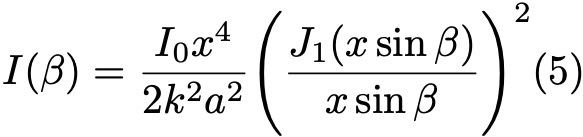
Формула 5.
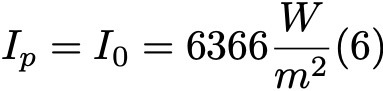
Формула 6.
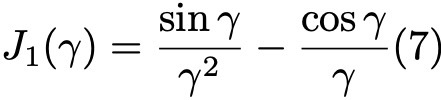
Формула 7.
Корзина пуста
0
шт.
/
0 руб.
Оформить
Очистить